がん治療にはさまざまな選択肢があり、
患者さんの状態や目的に応じて、適した治療が行われます。
がんの治療では、患者さんの症状や状態を考慮しながら、がんの克服や生活の質の向上をめざします。
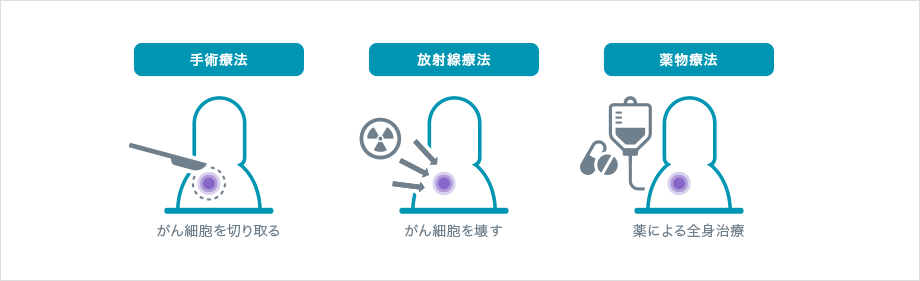
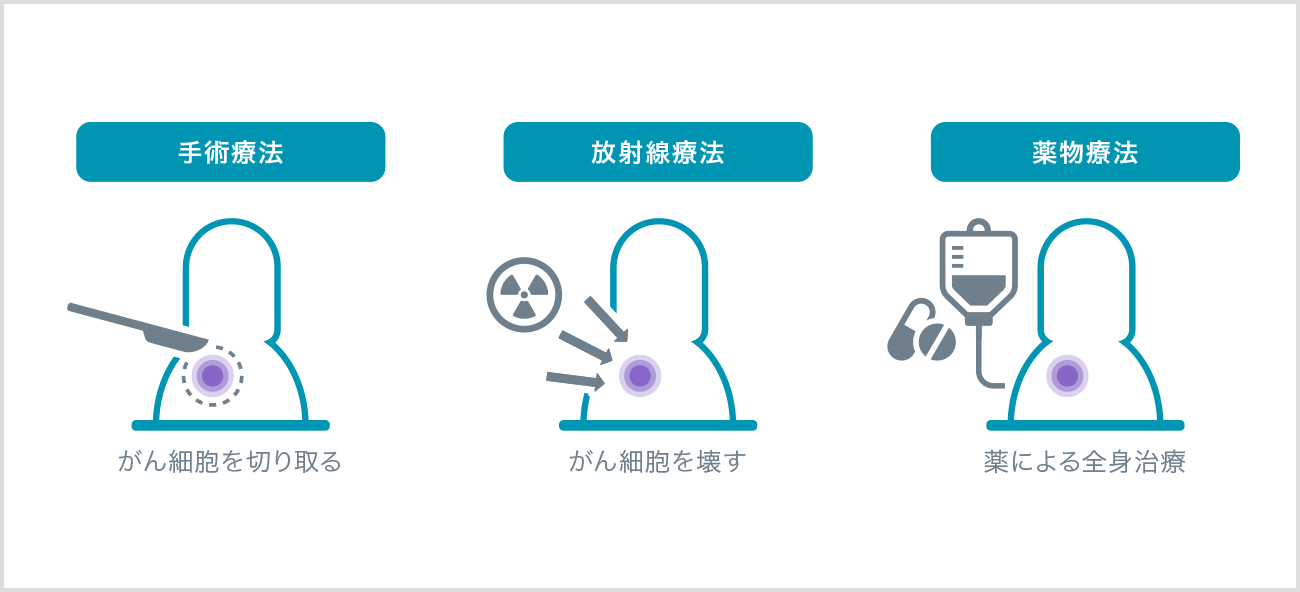
手術療法、放射線療法、薬物療法はがんの三大治療とされています。がん細胞の塊(かたまり)を物理的に切り取る手術療法、高いエネルギーをもつ光を当ててがん細胞を壊す放射線療法は、がんのある場所に対して局所的に行う治療法です。
一方、薬を飲んだり点滴したりする薬物療法は、全身に対して行う治療法です。がん細胞は発生した場所から広がり血液によって運ばれ、他の場所で大きくなることがありますが、全身治療である薬物療法は、移動したがん細胞に対する効果も期待されます。この薬物療法の進歩により、がん治療の考え方が変わってきています。
手術療法、放射線療法、薬物療法はがんの三大治療とされています。がん細胞の塊(かたまり)を物理的に切り取る手術療法、高いエネルギーをもつ光を当ててがん細胞を壊す放射線療法は、がんのある場所に対して局所的に行う治療法です。
一方、薬を飲んだり点滴したりする薬物療法は、全身に対して行う治療法です。がん細胞は発生した場所から広がり血液によって運ばれ、他の場所で大きくなることがありますが、全身治療である薬物療法は、移動したがん細胞に対する効果も期待されます。この薬物療法の進歩により、がん治療の考え方が変わってきています。
がんの三大治療
ピンチで図を拡大する
遺伝子の変化によってできた通常とは異なる働きを持ったタンパク質を
標的とする「分子標的薬」が進歩
薬物療法に用いられる薬には、従来の抗がん剤(化学療法)、ホルモン剤、分子標的薬、免疫チェックポイント阻害薬など作用の異なるさまざまな種類があります。
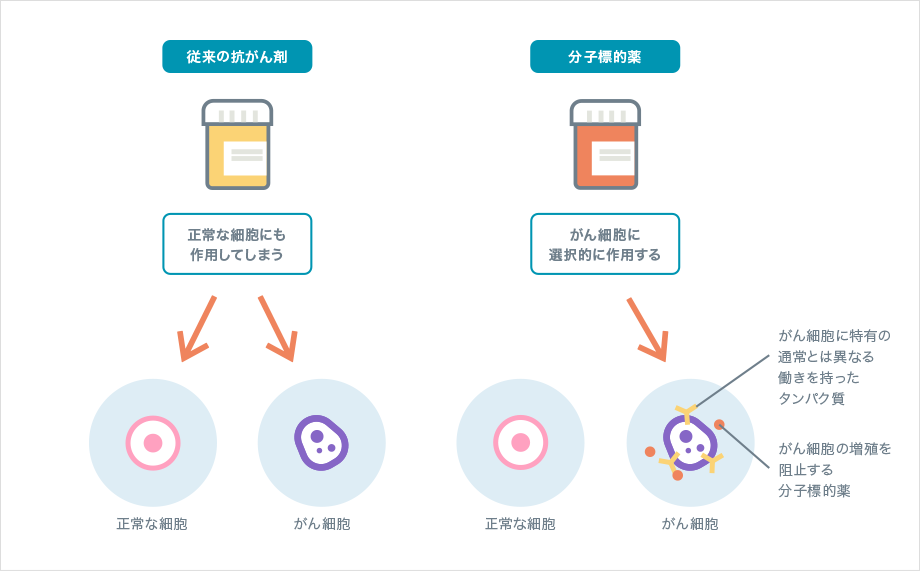
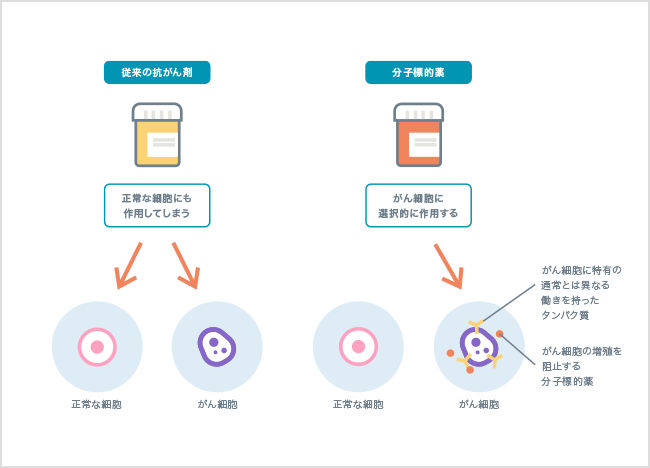
化学療法に使われる従来の抗がん剤は、細胞の分裂や働きを妨げ、破壊する効果があります。しかし、正常な細胞にも同様に作用するため、副作用が生じることも少なくありません。
これに対して、1990年以降に登場したのが「分子標的薬」です。がん細胞では、変化が起こった遺伝子の情報をもとにして、通常とは異なる働きを持ったタンパク質が作られます。分子標的薬はこの通常とは異なる働きを持ったタンパク質(分子)を標的として働きを妨げ、がん細胞に選択的に作用します。
化学療法に使われる従来の抗がん剤は、細胞の分裂や働きを妨げ、破壊する効果があります。しかし、正常な細胞にも同様に作用するため、副作用が生じることも少なくありません。
これに対して、1990年以降に登場したのが「分子標的薬」です。がん細胞では、変化が起こった遺伝子の情報をもとにして、通常とは異なる働きを持ったタンパク質が作られます。分子標的薬はこの通常とは異なる働きを持ったタンパク質(分子)を標的として働きを妨げ、がん細胞に選択的に作用します。
分子標的薬の働きと従来の抗がん剤
ピンチで図を拡大する
分子標的薬が効く可能性をあらかじめ判断するコンパニオン診断が普及
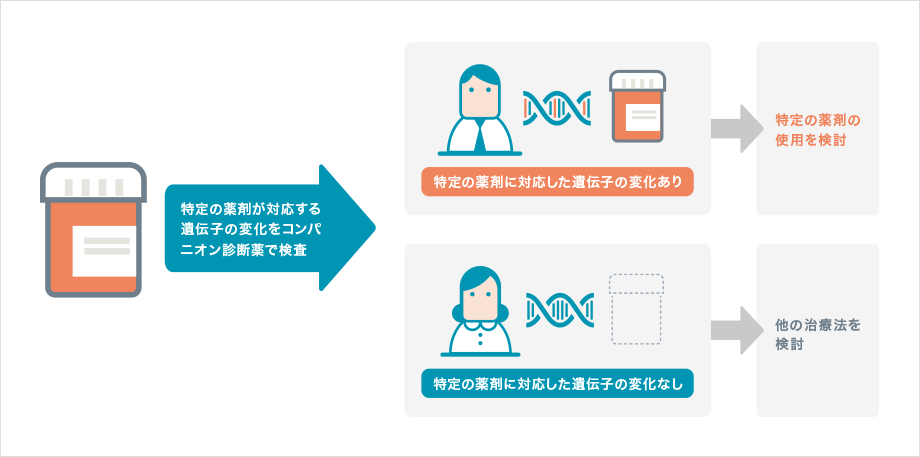
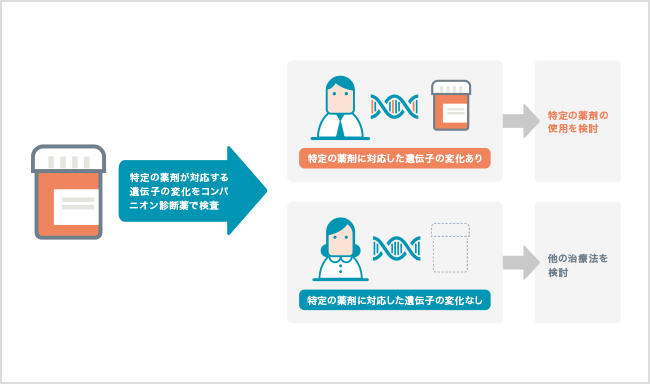
分子標的薬が標的とする通常とは異なる働きを持ったタンパク質は、遺伝子の変化によって作られるため、がん細胞の中に対応する遺伝子の変化があるかどうかを調べることが重要です。このような、特定の分子標的薬の効果や副作用をあらかじめ調べる検査は「コンパニオン診断」とよばれます。分子標的薬とセットで行われるコンパニオン診断は2011年ごろから普及しはじめました。
コンパニオン診断では、遺伝子検査で対象となる遺伝子に変化が見つかった場合には、その分子標的薬の効果が期待できます。反対に、その遺伝子の変化が見つからなければ、薬剤の効果は期待できない、と判断されます。
コンパニオン診断では、遺伝子検査で対象となる遺伝子に変化が見つかった場合には、その分子標的薬の効果が期待できます。反対に、その遺伝子の変化が見つからなければ、薬剤の効果は期待できない、と判断されます。
コンパニオン診断で目的の分子標的薬の効果を
あらかじめ予測する
あらかじめ予測する
ピンチで図を拡大する
がんの特徴を遺伝子レベルで調べる検査の技術も進歩
「がん遺伝子パネル検査」が登場
分子標的薬の開発にともなって、がんの特徴を遺伝子レベルで調べる遺伝子検査の技術も進歩してきました。2017年以降になると、「コンパニオン診断」に続いて、複数の遺伝子の変化を一度の検査で調べることができる「がん遺伝子パネル検査」が登場しました。
同じ臓器のがんでも、がんの遺伝子の変化の違いによって、
患者さん一人ひとりに合わせた薬剤の選択へ
【肺がんの例】
分子標的薬と遺伝子検査の進歩は、治療効果を大きく向上させるとともに、肺がんには肺がんの薬剤、胃がんには胃がんの薬剤といったように、臓器ごとに行われていた診断や治療を、大きく変えようとしています。肺がんを例にみていきましょう。
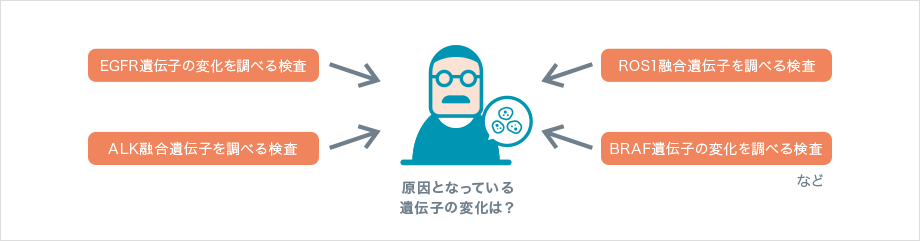
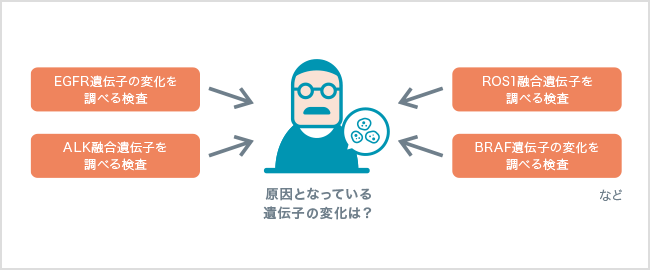
私たちの細胞の表面には、細胞の増殖に関わる「EGFR(epidermal growth factor receptor:上皮成長因子受容体)」とよばれるタンパク質が存在します。肺がんの細胞には、通常とは異なる働きを持ったEGFRタンパク質が多くみられます。そこで、通常とは異なるEGFRを標的とした分子標的薬が開発され、肺がんの治療に用いられるようになりました。
その後、この薬剤がよく効く患者さんがいる一方で、効き目のみられない患者さんがいることがわかってきました。よく効く患者さんの遺伝子を調べたところ、通常とは異なる働きを持ったEGFRタンパク質を作り出すEGFR遺伝子に変化が認められました。そのため現在は、この薬剤を使う前には必ず、EGFR遺伝子に変化があるかどうかをコンパニオン診断で調べることになっています。
肺がんの原因となるのは、EGFR遺伝子の変化だけではありません。他にも、肺がんの原因となる遺伝子の変化がいくつか(ALK融合遺伝子、ROS1融合遺伝子、BRAF遺伝子の変化など)見つかっており、それぞれに対して効果を示す分子標的薬が開発されました。
肺がんの治療方針を決めるためには、現在、いくつもの遺伝子検査を同時に行うことが推奨されています。今後、新たな薬剤が開発されれば、さらに多くの遺伝子の変化を調べることが必要になるでしょう。
このように、治療方針を決定するまでに多くの遺伝子を調べる必要があるがんなどで期待されるようになったのが、「がん遺伝子パネル検査」です。
分子標的薬と遺伝子検査の進歩は、治療効果を大きく向上させるとともに、肺がんには肺がんの薬剤、胃がんには胃がんの薬剤といったように、臓器ごとに行われていた診断や治療を、大きく変えようとしています。肺がんを例にみていきましょう。
私たちの細胞の表面には、細胞の増殖に関わる「EGFR(epidermal growth factor receptor:上皮成長因子受容体)」とよばれるタンパク質が存在します。肺がんの細胞には、通常とは異なる働きを持ったEGFRタンパク質が多くみられます。そこで、通常とは異なるEGFRを標的とした分子標的薬が開発され、肺がんの治療に用いられるようになりました。
その後、この薬剤がよく効く患者さんがいる一方で、効き目のみられない患者さんがいることがわかってきました。よく効く患者さんの遺伝子を調べたところ、通常とは異なる働きを持ったEGFRタンパク質を作り出すEGFR遺伝子に変化が認められました。そのため現在は、この薬剤を使う前には必ず、EGFR遺伝子に変化があるかどうかをコンパニオン診断で調べることになっています。
肺がんの原因となるのは、EGFR遺伝子の変化だけではありません。他にも、肺がんの原因となる遺伝子の変化がいくつか(ALK融合遺伝子、ROS1融合遺伝子、BRAF遺伝子の変化など)見つかっており、それぞれに対して効果を示す分子標的薬が開発されました。
肺がんの治療方針を決めるためには、現在、いくつもの遺伝子検査を同時に行うことが推奨されています。今後、新たな薬剤が開発されれば、さらに多くの遺伝子の変化を調べることが必要になるでしょう。
このように、治療方針を決定するまでに多くの遺伝子を調べる必要があるがんなどで期待されるようになったのが、「がん遺伝子パネル検査」です。
肺がんでは治療前にいくつもの遺伝子検査が必要となる
ピンチで図を拡大する
違う臓器のがんでも、共通のがんの遺伝子の変化があると、
同じ薬剤が効果を示すことも
【HER2の例】
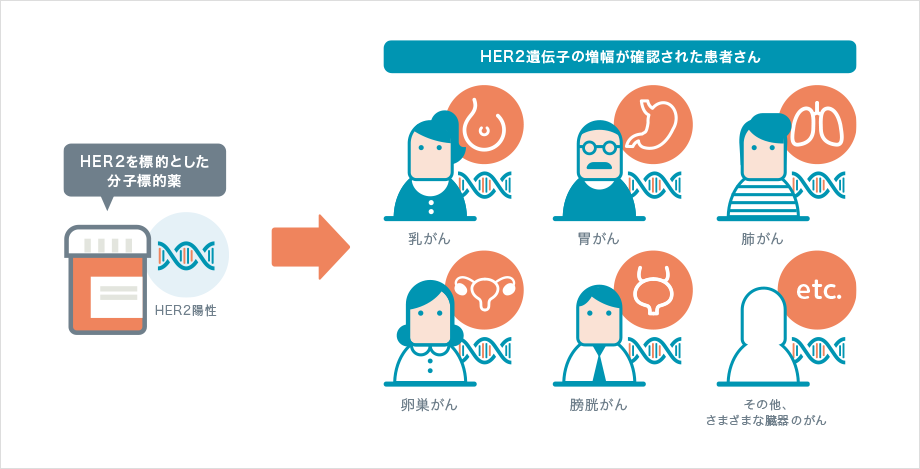
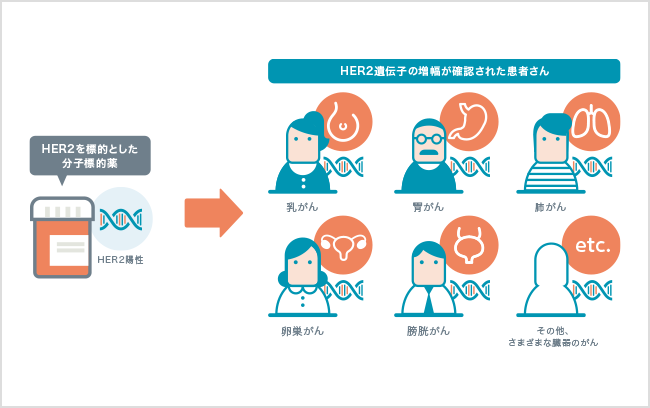
これまで乳がんや胃がんの治療に使われてきた分子標的薬に「HER2(ハーツー)」とよばれるタンパク質を標的とするものがあります。近年、通常とは異なる働きを持ったHER2が乳がんや胃がんだけでなく、卵巣がん、肺がん、膀胱がんなど、さまざまな臓器で発生したがん細胞に見つかり、これらのどのがんの治療にも効果を示すと分かりました。
このような例は他の分子標的薬や免疫チェックポイント阻害薬でも報告されており、臓器別ではなく遺伝子レベルでがんの特徴を捉え、それに合わせてがんを分類・治療するという考え方の重要性が高まっています。2018年以降、国内においても臓器別ではなく遺伝子の変化別の、臓器横断的ながんを対象とした薬剤が承認されており、今後ますます「がん遺伝子パネル検査」の果たす役割が大きくなると考えられます。次の【固形がんの例】の章では、具体的な例をあげて説明します。
これまで乳がんや胃がんの治療に使われてきた分子標的薬に「HER2(ハーツー)」とよばれるタンパク質を標的とするものがあります。近年、通常とは異なる働きを持ったHER2が乳がんや胃がんだけでなく、卵巣がん、肺がん、膀胱がんなど、さまざまな臓器で発生したがん細胞に見つかり、これらのどのがんの治療にも効果を示すと分かりました。
このような例は他の分子標的薬や免疫チェックポイント阻害薬でも報告されており、臓器別ではなく遺伝子レベルでがんの特徴を捉え、それに合わせてがんを分類・治療するという考え方の重要性が高まっています。2018年以降、国内においても臓器別ではなく遺伝子の変化別の、臓器横断的ながんを対象とした薬剤が承認されており、今後ますます「がん遺伝子パネル検査」の果たす役割が大きくなると考えられます。次の【固形がんの例】の章では、具体的な例をあげて説明します。
* 国が認可して保険適用となっているがんは2023年3月現在、HER2過剰発現が確認された乳がん、HER2過剰発現が確認された治癒切除不能な進行・再発の胃がん、HER2陽性の根治切除不能な進行・再発の唾液腺がんおよびがん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の大腸がんです。
乳がんの分子標的薬が
他のさまざまな臓器のがんで効果を示した
他のさまざまな臓器のがんで効果を示した
ピンチで図を拡大する
【固形がんの例】
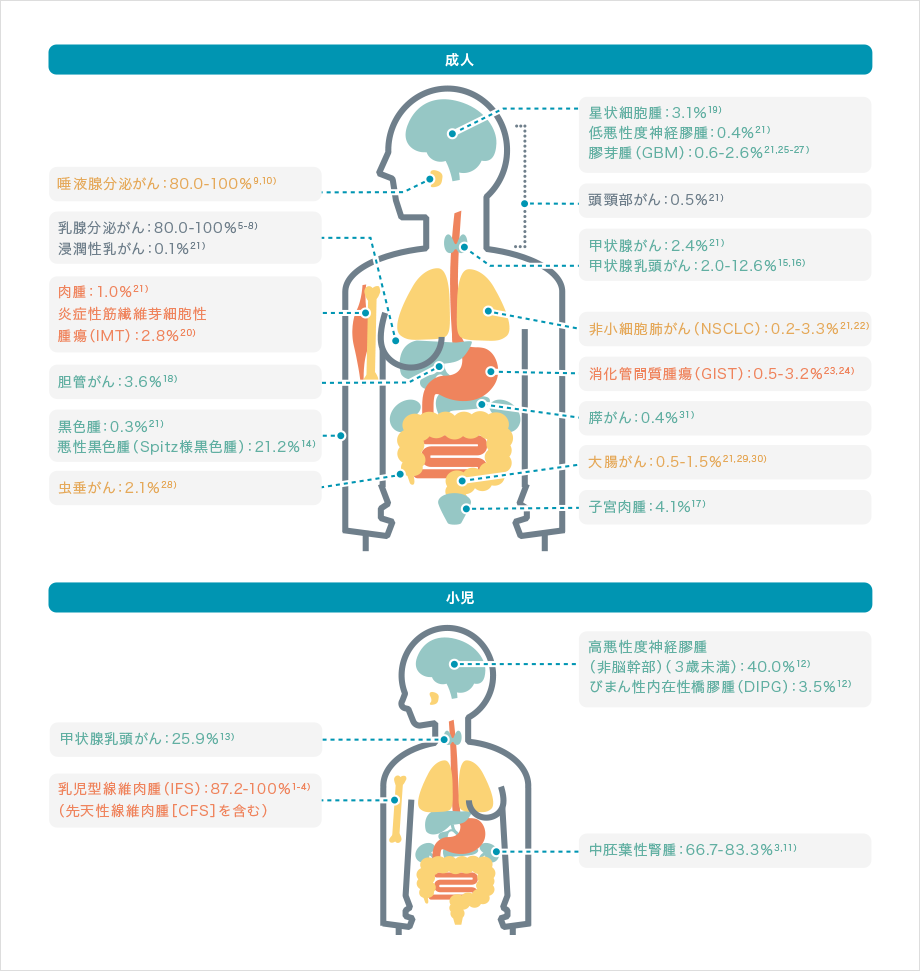
血液がん(白血病、悪性リンパ腫など)以外の、臓器や組織などでがん細胞がかたまりを作り、増殖するタイプのがん(肺がん、大腸がん、乳がんなど)を「固形がん」とよびます。この固形がんで、まれに「NTRK融合遺伝子」という通常とは異なる遺伝子が見つかることが知られています。
NTRK融合遺伝子は、成人でも小児でも、また大腸がんや肺がん、卵巣がんの他、神経や乳腺などさまざまな臓器のがん細胞から見つかっています。
NTRK融合遺伝子は、細胞内で働く正常なNTRK遺伝子の一部が他の遺伝子と融合した、通常とは異なる遺伝子で、がん細胞の増殖を促すTRK融合タンパクを作り出すと考えられています。
近年、TRK融合タンパクの働きを抑える分子標的薬が開発されました。NTRK融合遺伝子がある固形がんには、この薬剤が効果を示す可能性があります。
このように、臓器の種類に関わらない、まれな遺伝子の変化が関係しているがんの場合、「がん遺伝子パネル検査」を行うことで原因の特定につながり、より適した薬剤が見つかる可能性があります。
血液がん(白血病、悪性リンパ腫など)以外の、臓器や組織などでがん細胞がかたまりを作り、増殖するタイプのがん(肺がん、大腸がん、乳がんなど)を「固形がん」とよびます。この固形がんで、まれに「NTRK融合遺伝子」という通常とは異なる遺伝子が見つかることが知られています。
NTRK融合遺伝子は、成人でも小児でも、また大腸がんや肺がん、卵巣がんの他、神経や乳腺などさまざまな臓器のがん細胞から見つかっています。
NTRK融合遺伝子は、細胞内で働く正常なNTRK遺伝子の一部が他の遺伝子と融合した、通常とは異なる遺伝子で、がん細胞の増殖を促すTRK融合タンパクを作り出すと考えられています。
近年、TRK融合タンパクの働きを抑える分子標的薬が開発されました。NTRK融合遺伝子がある固形がんには、この薬剤が効果を示す可能性があります。
このように、臓器の種類に関わらない、まれな遺伝子の変化が関係しているがんの場合、「がん遺伝子パネル検査」を行うことで原因の特定につながり、より適した薬剤が見つかる可能性があります。
NTRK融合遺伝子が見つかっているがん
1)Orbach D, et al.: Eur J Cancer 57: 1-9, 2016 2)Knezevich SR, et al.: Nat Genet 18(2): 184-187, 1998 3)Rubin BP, et al.: Am J Pathol 153(5): 1451-58, 1998 4)Bourgeois JM, et al.: Am J Surg Pathol 24(7): 937-946, 2000 5)Del Castillo M, et al.: Am J Surg Pathol 39(11): 1458-67, 2015 6)Makretsov N, et al.: Genes Chromosomes Cancer 40(2): 152-7, 2004 7)Tognon C, et al.: Cancer Cell 2(5): 367-76,, 2014 15)Musholt TJ, et al.: Surgery 128(6): 984-93, 2000 16)Leeman-Neill RJ, et al. Cancer 120(6): 799-807, 2014 17)Chiang S, et al.: Am J Surg Pathol 42(6):2002 8)Laé M, et al.: Mod Pathol 22(2): 291-98, 2009 9)Skálová A, et al.: Am J Surg Pathol 40(1): 3-13, 2016 10)Bishop JA, et al.: Hum Pathol 44(10): 1982-1988, 2013 11)Knezevich SR, et al.: Cancer Res 58(22): 5046-48, 1998 12)Wu G, et al.: Nat Genet 46(5): 444-50, 2014 13)Prasad ML, et al.: Cancer 122(7): 1097-107, 2016 14)Wiesner T, et al.: Nat Commun 5: 3116 791-798, 2018 18)Ross JS, et al.: Oncologist 19(3): 235-42, 2014 19)Jones DT, et al.: Nat Genet 45(8): 927-932, 2013 20)Yamamoto H, et al.: Histopathology 69(1): 72-83, 2016 21)Stransky N, et al.: Nat Commun 5: 4846, 2014 22)Vaishnavi A, et al.: Nat Med 19(11): 1469-72, 2013 23)Shi E, et al.: J Transl Med 14(1): 339, 2016 24)Brenca M, et al.: J Pathol 238(4): 543-49, 2016 25)Kim J, et al.: PLoS One 9(3): e91940, 2014 26)Frattini V, et al.: Nat Genet 45(10): 1141-1149, 2013 27)Zheng Z, et al.: Nat Med 20(12): 1479-1484, 2014 28)Chen Y, et al.: J Hematol Oncol 11(1): 78, 2018 29)Ardini E, et al.: Mol Oncol 8(8): 1495-1507, 2014 30)Creancier L, et al.: Cancer Lett 365(1): 107-111, 2015 31)Zehir A, et al.: Nat Med 23(6): 703-713, 2017を元に作図
ピンチで図を拡大する